摘要:为了研究糙小米(BM)经过发芽(GM)、挤压膨化(EM)和超微粉碎(UM)连续加工过程中游离多酚组分和抗氧化活性的变化,采用高效液相色谱质谱联用法(HPLC-MS)分析了糙小米多酚组分,并进行了体外抗氧化实验和秀丽隐杆线虫体内实验分析糙小米游离多酚抗氧化活性的变化。结果表明:各加工阶段产品的游离多酚含量均显著高于BM(P<0.05),GM比BM增加了84.16%,EM和UM的游离多酚含量持续增加,UM含量最高为(26.37±0.40)mg/g DW。糙小米中共检测到18种游离态多酚,其中BM仅检测到8种,GM中检测到11种多酚组分,对比BM变化了7种。EM和UM对比GM处理变化较小,可溶性结合酚类组分增加,但是肉桂酸和阿魏酸衍生物减少。GM的羟基自由基(·OH)清除率和铁离子还原能力(FRAP)以及秀丽隐杆线虫超氧化物歧化酶(SOD)活力[(2.74±0.23) U/mL]、谷胱甘肽过氧化物酶(GSH-Px)活力[(30.30±0.96)nmol/min/mL]、丙二醛(MDA)降低水平和12d存活率都显著(P<0.05)高于其他组。EM和UM之间抗氧化活性差异不大,但均显著(P<0.05)高于BM。发芽处理可以显著增加游离多酚的含量和组成,挤压和超微加工进一步促进游离多酚的释放,各个加工阶段产品中游离多酚的抗氧化活性均高于对照,多酚组分对抗氧化活性的影响大于含量。
关键词:糙小米;游离态多酚;组分分析;抗氧化活性
多酚是植物体内天然的次生代谢产物,被称为有效的抗氧化剂、自由基清除剂和金属螯合剂[1],根据存在形式可分为游离态多酚、可溶性-结合态多酚和不溶性-结合态多酚,其中,游离多酚可以直接被萃取,摄入后能够被小肠迅速吸收[2]。小米中含有丰富的多酚类物质[3],例如羟基苯甲酸,羟基肉桂酸和黄酮类化合物,张玲艳等[4]通过对11种谷子多酚含量研究得出,总酚均值为4.12mg GAE/g DW,其中游离酚含量变化范围为0.69~2.31mg GAE/g DW,小米多酚纯化后对DPPH自由基、ABTS+自由基和超氧阴离子自由基的清除清除率分别高达73.09%、99.31%和93.57%,具有良好的抗氧化活性和还原性[5]。
仅去壳的谷子称为糙小米,保留完整形态、碾成粉状、碎块状或压成片状的糙小米是一种全谷物。糙小米不易被直接食用,通过发芽[6,7]、挤压膨化[8,9]和超微粉碎[10]的连续加工可改善糙小米的营养价值、风味和质地,使产品具有较高的商业价值,萌发是植物种子提高多酚含量和抗氧化活性的有效方法,大麦发芽24h过程中,总酚含量持续增加[11];玉米和小米发芽96h后,游离多酚含量和抗氧化活性增加[12]。挤压处理在改善全谷物风味和质地方面可以发挥重要作用,但是不同的研究发现挤压处理对多酚的影响存在较大差异,有研究发现挤压会造成总酚含量明显降低,尤其是花青素损失42%~90%[13];而另外的研究则发现,挤压会导致游离酚含量增加[14]。超微粉碎不仅能够减小原料的粒径,而且能破碎植物细胞壁,有利于活性物质溶出[10],赵萌萌等[15]研究得出粒径越小的青稞麸皮微粉中总酚含量越多。因此,对于糙小米加工过程中游离多酚组分和抗氧化活性变化的研究是有必要的。
以糙小米的不同加工阶段的产物为研究对象,通过高效液相色谱-质谱联用法(HPLC-MS)分析不同加工阶段糙小米游离态多酚组分差异,采用羟基自由基清除率、铁离子还原能力、吸收过氧自由基能力等体外实验和秀丽隐杆线虫体内抗氧化性研究相结合的手段,系统分析在不同加工阶段的糙小米游离多酚抗氧化活性的变化机理,为开发高品质糙小米全谷物冲调粉产品提供参考。
1 材料与方法
1.1 材料与试剂
糙小米,由山东省农业科学院作物研究所杂粮实验室提供;秀丽隐杆线虫N2(野生型);乙腈、甲醇、甲酸,均为色谱级;对硝基苯-a-d-吡喃葡萄糖苷(PNPG)、荧光素(FL)、2′,7′-二氯二氢荧光素(H2DCF-DA)、5-氟尿嘧啶、2,2-偶氮二异丁基脒盐酸盐(ABAP)、丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒。
1.2 仪器与设备
FW177粉碎机,Syslg32-11挤压膨化机,CWFJ-8超微粉碎机,HClass XEVOG2SQTof液相色谱-质谱联用仪,Varioskan LUX酶标仪,Shimadzu UV-2600紫外分管光度仪,GZX-9240MBE鼓风干燥机,Axio Observer倒置荧光显微镜。
1.3 方法
1.3.1 糙小米样品制备
将糙小米干燥后粉碎,得到糙小米样品(BM),置于-80℃冰箱备。取一部分去壳小米种子,按小米质量与蒸馏水体积1∶3比例加入蒸馏水,置于温度25℃、相对湿度80%~90%的恒温培养箱中进行发芽培养,当数量80%左右小米胚芽长2cm时,停止培养,将发芽完成的样品放在鼓风干燥箱内40~45℃热风干燥,进行灭酶和干燥处理,干燥至物料水质量分数小于10%,将干燥好的样品迅速冷却至室温,粉碎,得到发芽糙小米样品(GM),置于-80℃冰箱备用。将GM样品的一部分进行挤压膨化处理,将发芽小米粉调整至水质量分数23%(加水约10%)、挤压机转速25r/min、挤压温度第一段温度为50℃,第二段温度80℃,挤压温度为110℃,挤出样品晾干后进行粉碎,得到挤压样品(EM),置于-80℃的冰箱中备用。取一部分EM样品进行超微粉碎处理,使其全部透过120目筛,即得到超微粉碎样品(UM),置于-80℃的冰箱中备用。
1.3.2 糙小米游离多酚提取
使用实验室改进方法,准确称取5g样品与50mL的酸化甲醇提取液(95%甲醇∶1mol/L HCl体积比为85∶15)混合置于500mL三角瓶中,加塞后放入摇床常温提取2h,以5000r/min离心10min,得上清液和残渣;将残渣按照相同方法再提取2次,将3次所得上清液合并,按料液体积比1∶10加入正己烷去除油脂,使用旋转蒸发仪在45℃下将其减压浓缩,将浓缩液用纯水复溶,定容到50mL,保存在-20℃冰箱中备用。
1.3.3 糙小米游离多酚及基础组分含量测定
参考田志琴[5]的方法略有改动,准确吸取样品溶液2mL于10mL容量瓶中,分别加入蒸馏水6mL、Folin-Ciocalteu试剂0.5mL和75g/L的Na2CO3溶液1.5mL,加水稀释至刻度,混匀,75℃水浴10min,冷却至室温,并使用紫外分光光度计在波长760nm处测定吸光度A。以梯度浓度的没食子酸标准溶液做标准曲线,得到公式y=0.0526x+0.0267(r2=0.999)(y是标准品吸光度,x是标准品浓度),按照标准曲线计算样品质量浓度。多酚含量测定结果以干基1g样品中所含没食子酸当量表示。水质量分数按GB 5009.3—2016方法测定。蛋白质含量按凯氏定氮法测定。总淀粉含量按GB 5009.9—2016方法测定。
1.3.4 糙小米游离多酚组分分析
参考Tsolmon等[16]的方法略有改动,取2g样品,加入20mL体积分数0.1%的甲酸甲醇溶液,置于4℃冰箱过夜,将提取液过萃取小柱纯化处理,最后加入超纯水,将提取液中的甲醇溶液体积分数调至60%,取1mL过0.22μm膜,用于液相色谱-质谱联用仪分析。UPLC条件:Acquity BEH C18柱(1.7μm,2.1mmx50mm);柱温35℃;流速0.3mL/min;进样量6μL;流动相A(体积分数0.1%甲酸),B(体积分数100%乙腈),梯度洗脱条件:0.0~2.0min,95% A;2.0~3.0min,95%~85% A;3.0~5.0min,85%~65% A;5.0~7.0min,65%~45% A;7.0~9.0min,45~25% A;9.0~11.0min,25%~5% A;11.0~11.1min,5%~95% A;11.1~14.0min,95% A。检测波长为280nm;MS条件:ESI+,离子源温度为120℃,毛细管电压为3.0kV,锥孔气流量为50L/h,脱溶剂温度为400℃,脱溶剂气体流量为600L/h,扫描范围m/z为100~700,低能量5eV,高能量10~30eV,锥孔电压20V。
1.3.5 糙小米游离多酚羟基自由基(·OH)清除率的测定
参考陈金祥[17]的方法,羟自由基清除率采用Fenton体系测定。将样品做适当稀释,在试管中依次加入0.2mL硫酸亚铁(6mmol/L)、0.2mL过氧化氢(6mmol/L)、1mL水杨酸-乙醇(6mmol/L)、0.2mL适当稀释后的样品,充分混匀后将试管放置在37℃水浴中反应15min,以不加过氧化氢作为空白,不加样品作为对照,于510nm波长处测定吸光度。羟自由基清除率按式(1)计算:

式中:A为样品的吸光值;A0为空白的吸光值;Ai为对照的吸光值。
1.3.6 糙小米游离多酚的铁离子还原能力的测定(FRAP)
参考Iqbal等[18]的方法,将pH=3.6的300mmol/L醋酸缓冲液、10mmol/LTPTZ溶液和20mmol/L的FeCl3溶液以体积比10∶1∶1的比例混合,37℃保温30min,制得FRAP试剂,于96孔板中加入180 μL FRAP工作液,在检测孔内加入5μL已知浓度的样品,37℃孵育15min后,在593nm波长处测定吸光度值,用蒸馏水代替样品做空白,以梯度浓度的Trolox标准溶液做标准曲线,得到相关系数公式y=0.000838x+0.003(r2=0.998)(y是标准品吸光度,x是标准品浓度),根据相关系数公式计算出以Trolox含量表示的样品浓度,FRAP值以每克多酚干粉等同于Trolox的含量表示(μmol Trolox/g DW),FRAP值按式(2)计算。

式中:C为样品的浓度;Ci为以Trolox含量表示的样品浓度。
1.3.7 糙小米游离多酚对秀丽隐杆线虫的影响测定
1.3.7.1 线虫体内抗氧化酶水平和丙二醛含量(MDA)测定
参考Moliner等[19]的方法培养秀丽隐杆线虫(Caenorhabditis elegans),将同期化的L4期线虫转移至NGM给样平板中,其中对照组仅含E.coli OP50菌液,每板含50条线虫。20℃培养2d后,用M9缓冲液将线虫冲洗至离心管中,于4℃,1000r/min离心10min,去除上清液,重复清洗2~3次。加入0.5mL M9缓冲液重悬线虫,并于冰浴条件下超声破碎2min,之后于4℃,12000r/min离心10min,取上清液按照试剂盒说明书步骤,测定线虫体内丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的水平。
1.3.7.2 线虫寿命实验
所有的寿命实验均在20℃的恒温条件下进行,用于寿命实验的NGM板还需含12.5mg/L的5-氟脲嘧啶和质量分数10%的样品,对照组不加样品。挑取30条L4期的雌雄同体线虫至NGM培养皿中,把L4期幼虫转移的当天定义为第0天。每隔3d将其转移到新的NGM培养皿中,每2d计数线虫存活条数。本组实验独立重复3次。
1.4 数据分析
除特殊标注外每个处理均测定3次,取3次平均值作为测定结果。采用SPSS和Origin进行统计分析和作图,取其平均值,运用Duncan检验进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 糙小米游离多酚及基础组分含量的变化
小米游离态多酚、水分、蛋白质、脂肪和总淀粉含量结果如表1所示,发芽处理显著提升了多酚含量,GM多酚含量为(23.83±0.05)mg/g DW,比BM提高了84.10%,EM游离多酚含量则略高于GM,但二者不存在显著差异(P>0.05),UM多酚含量比EM提高10.66%。水分随着加工呈降低趋势,GM蛋白质含量显著增加(P<0.05),脂肪和总淀粉含量显著降低(P<0.05),EM和UM蛋白质含量较GM显著下降(P<0.05),脂肪和总淀粉含量较GM变化不大。根据Sharma等[20]的研究,GM多酚含量增加是因为小米发芽过程中在内源酶的作用下使多酚组分发生变化,使游离多酚含量增加,这一过程需要分解脂肪和淀粉来提供能量,并为幼株发育储存氮源[21]。另外,种子发芽后细胞壁降解酶活化,导致结合酚释放和新游离多酚的生物合成,并改善其抗氧化特性[22,23]。
表1 糙小米游离多酚、水分、蛋白质、脂肪和总淀粉含量
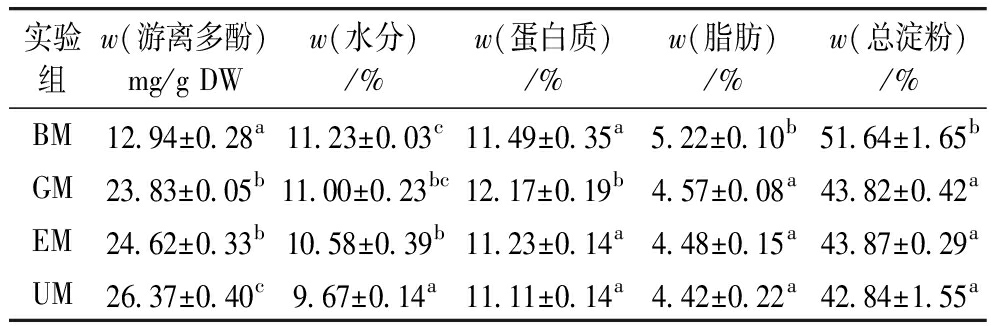
注:同列标有不同字母表示差异显著(P<0.05)。
挤压处理的高剪切作用促进多酚析出,提高了游离酚含量,但是,挤压过程中的高温会使多酚发生降解、脱羧、聚合反应,又降低了多酚含量和生物活性,也使总氨基酸含量降低[14]。总体来看,EM与GM相差不大,这与Wen等[24]的研究结果相一致,也进一步验证了温和的挤压条件可能会减少对多酚的破坏。超微粉碎可能是进一步破坏糙小米细胞壁结构,促进一部分多酚释放,从而使游离酚含量增加。
2.2 糙小米游离多酚组分的变化
根据一级质谱和二级质谱结果,从本实验室自建库中共筛选出18种响应强度高的多酚类物质,如表2所示。BM中鉴定出8种多酚类物质,包括5种糖苷取代基类山奈酚为主的黄酮类、矢车菊黄素、绿原酸丁酯和对羟基苯甲酸等,糖苷基组分相对占比较高。GM多酚类物质增加至11种,其中有7种多酚与BM不同,可以看出BM中黄酮类物质多转化为儿茶素,糖苷取代基消失,并新增加了肉桂酸衍生物和阿魏酸衍生物。Beitane等[25]也发现,种子发芽后阿魏酸、咖啡酸和儿茶素等含量会急剧增加,而种子萌发后α-淀粉酶、β-淀粉酶和分支酶含量增加,能够分解原来的多酚-糖苷键[26],使多酚糖苷取代基消失。
表2 糙小米游离多酚的组分鉴定

注:“—”为未检测到。
EM与GM相比,阿魏酸类种类减少,3羟基肉桂酸变成反式-4-羟基肉桂酸被检测到,增加了绿原酸丁酯,其余多酚种类变化不大,这是由于挤压处理的高温作用破坏了多酚结构或使多酚结构改变[13]。UM与EM对比,新增加了3,4-二羟基-反式-肉桂酸苯乙酯,其余多酚组分基本不变。Khosravi等[27]认为超微粉碎工艺的高剪切力能够破坏细胞壁结构,使通过酯、醚或糖苷键连接到细胞壁上的结合酚析出[10],转变成游离酚被检测到。从本研究可以发现,适宜的超微粉碎和挤压处理能够促进结合酚的释放,从而增加游离酚种类,且对原有游离酚组分破坏性较小,对于保持热敏性组分活性是有益的。不过,需要注意的是,EM和UM溶出的主要是以酯键结合的溶解性组分,这可能对游离酚的活性产生一定影响。
2.3 糙小米游离多酚的羟基自由基清除率(·OH)和铁离子还原能力(FRAP)
多酚通过给出氢原子(HAT)或电子(SET)起到抗氧化作用,羟基自由基清除能力反映了电子提供能力[17]。如图1所示,GM对·OH清除效果显著高于其他组(P<0.05),比BM高28.35%,UM和EM之间无显著差异(P>0.05),但均显著高于BM(P<0.05)。FRAP与·OH清除率结果一致,GM仍然表现了最高的铁离子还原能力,比BM高40.08%(P<0.05),EM和UM之间无明显差异(P>0.05),但仍然显著高于BM(P<0.05)。
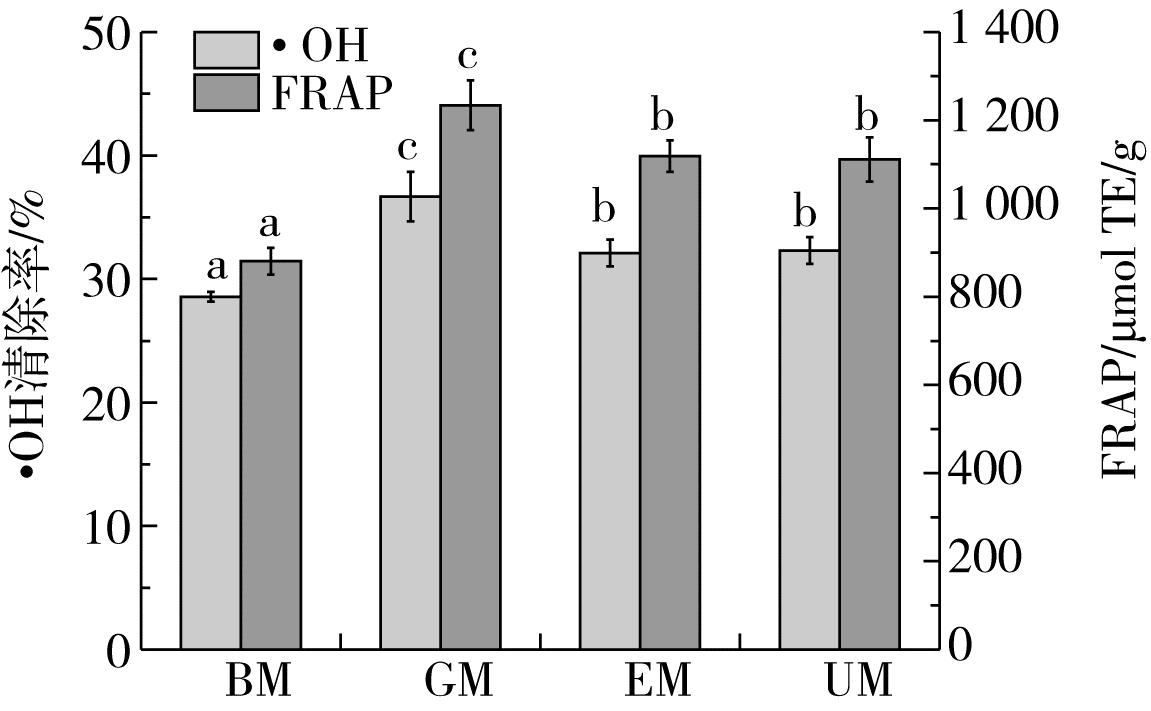
注:同标不同字母表示差异显著(P<0.05),余同。
图1 糙小米游离多酚的·OH自由基清除率和FRAP值
通常情况下,羟自由基清除率、铁离子还原能力与多酚浓度成正比,这也是加工处理组·OH清除率、FRAP提升的主要原因;另外,不同多酚组分与抗氧化活性相关性也有很大差异[28],从游离多酚组分上看,GM增加了儿茶素类、肉桂酸类和阿魏酸类组分(表2),也能使GM的·OH清除率和FRAP值增加,EM和UM游离多酚增加的部分多为以酯键结合的溶解性成分,而具有较强电子提供能力的阿魏酸等组分的含量下降(表2),可能导致EM和UM的·OH清除率和FRAP值低于GM。
2.4 糙小米游离多酚对线虫体内抗氧化酶和MDA的影响
SOD和GSH-Px均能保护秀丽隐杆线虫免受ROS侵害,此外,过量的氧自由基会与细胞膜上的不饱和脂肪酸发生反应,从而导致脂质过氧化终产物MDA的堆积[29]。如图2所示,加入游离多酚样品后,线虫体内SOD和GSH-Px活力较对照显著增加(P<0.05),变化趋势与羟基自由基清除率和铁离子还原能力结果一致,GM的SOD活力为(2.74±0.23)U/mL,GSH-Px活力为(30.30±0.96)nmol/(min·mL),分别高于对照199.07%和25.44%,UM和EM的SOD和GSH-Px活性相差不大,但略高于BM。研究发现,多酚可以通过上调相关基因表达,使抗氧化酶活力提高[30,31]。
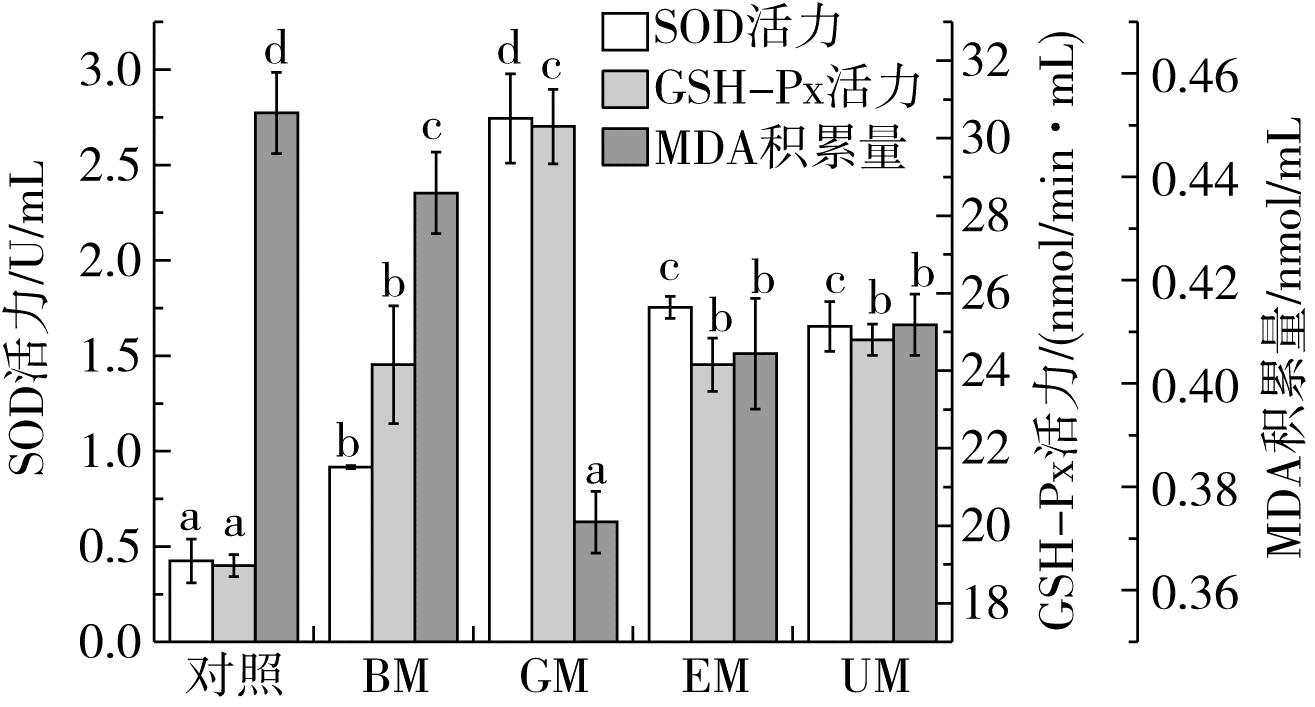
图2 秀丽隐杆线虫的SOD活性、GSH-Px活力和MDA积累量
图2还可以看出,加入样品后,MDA水平也出现显著下降,其中GM的抗氧化活性表现最强,仅为(0.42±0.01)nmol/mL,最终产品UM的抗氧化酶活性和MDA降低水平较EM变化不大,低于GM,但高于BM。多酚物质通过直接或增加抗氧化酶含量来清除ROS,使MDA积累量发生变化,而GM的抗氧化水平高于游离多酚含量更高的UM,这与多酚种类变化有关,根据2.2结果,UM游离多酚虽然含量最高,但主要表现为酯类取代基游离酚的增加,而酯类结合酚的抗氧化活性远低于游离酚[32],抗氧化水平与2.3结果一致。
2.5 糙小米游离多酚对线虫寿命的影响
秀丽隐杆线虫生长过程中,当机体产生氧自由基与清除氧自由基能力失衡后,会引起机体损伤,降低自身寿命[33]。对照线虫在培养12d后存活率开始低于4个处理,且呈直线下降趋势,而多酚样品组线虫存活率均显著高于对照,存活率下降较为缓慢(图3),与Moliner等[34]的研究结果一致。研究发现胰岛素/IGF信号(IIS)途径是控制线虫衰老的关键途径,多酚活性物质能够促进IIS途径中DAF-16和HSP-1基因上调,从而延长线虫寿命[19]。相同培养时间下GM组线虫存活率最高,其他组存活率高低为:UM>EM>BM>对照,培养30d时线虫全部死亡,而此时GM组仍有接近13.33%的线虫存活,与体外抗氧化结果一致,采用秀丽隐杆线虫模型评价的糙小米游离酚抗氧化活性,不同测试指标的结果表现了一致性,因此,多酚浓度并不是评价抗氧化活性的唯一标准,更要考虑组分的影响。
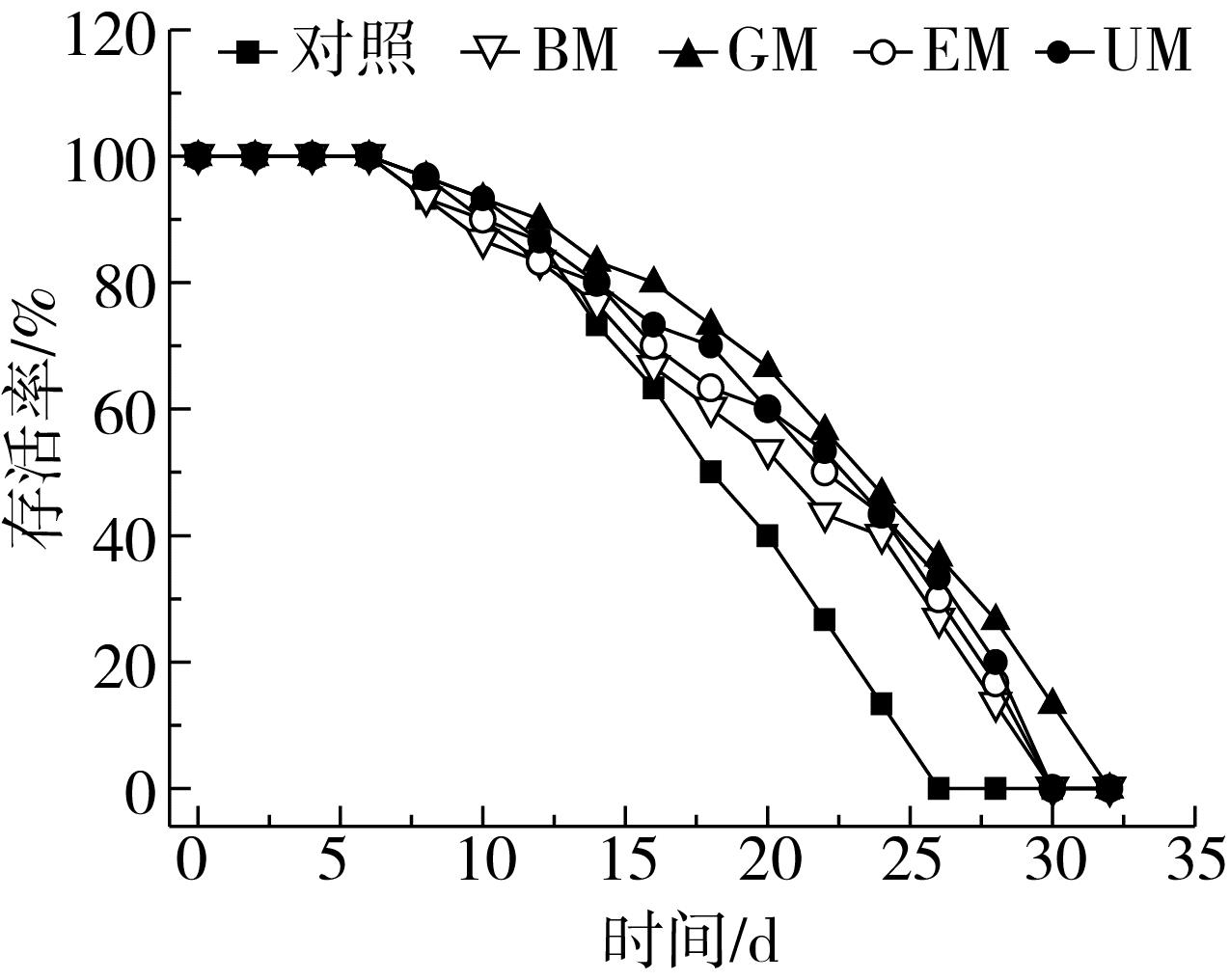
图3 秀丽隐杆线虫的存活率
3 结论
糙小米全谷物产品在加工过程中游离多酚组分和含量均发生变化。GM糖苷基组分减少,肉桂酸和阿魏酸衍生物增加,对比BM,游离态多酚种类和含量均显著提升;EM和UM游离态多酚含量持续增加,但肉桂酸和阿魏酸衍生物组分减少。通过线虫体内和体外抗氧化实验表明,多酚含量的增加并不一定会导致抗氧化活性提升,而通常与多酚组分有更大的关联。本研究发现发芽能够显著提高中间产品抗氧化活性,后续超微粉碎处理能进一步提高多酚含量,使最终产品抗氧化活性比未处理组明显增加,达到预期效果,可为糙小米产品开发提供参考。
参考文献
[1]BARBA F J.Innovative thermal and non-thermal processing, bioaccessibility and bioavailability of nutrients and bioactive compounds [M]. Cambridge: Woodhead Publishing, 2019: 309-332
[2]A A K D, B V S A. Antioxidative free and bound phenolic constituents in pericarp, germ and endosperm of Indian dent (Zea mays var. indentata)and flint(Zea mays var. indurata) maize[J]. Journal of Functional Foods, 2015, 13:363-374
[3]AKANBI T O, TIMILSENA Y, DHITAL S. Bioactives from millet: properties and effects of processing on bioavailability[M]. Bioactive Factors and Processing Technology for Cereal Foods, 2019: 171-183
[4]张玲艳, 韩飞, 范柳萍. 11种谷子营养成分及脱壳对酚类物质含量的影响[J].安徽农业科学, 2015, 43(36):117-122
ZHANG Y L, HAN F, FAN L P. The nutritional composition of 11 varieties of millet and the effect of shelling on phenolics content of millet[J]. Journal of Anhui Agricultural Sciences, 2015, 43(36):117-122
[5]田志琴. 小米多酚类活性物质的提取及抗氧化性研究[D]. 郑州: 河南工业大学, 2013: 53
TIAN Z Q. The studies on extraction andqtoxidant activities of foxtail millet ployphenol[D]. Zhengzhou: University of Technology, 2013: 53
[6]XIANG J, YUAN Y, DU L, et al. Modification on phenolic profiles and enhancement of antioxidant activity of proso millets during germination [J]. Food Chemistry: X, 2023, 18: 1-10
[7]POPOOLA O O. Phenolic compounds composition and in vitro antioxidant activity of Nigerian Amaranthus viridis seed as affected by autoclaving and germination[J].Measurement: Food, 2022, 6: 1-7
[8]郭新月, 张美莉, 霍瑞. 微粉碎协同挤压膨化处理燕麦麸皮的综合评价及应用[J].中国粮油学报, 2022, 37(9): 117-123
GUO X Y, ZHANG M L, HUO R. Comprehensive evaluation and application of combined processing of micro-pulverization and extrusion[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(9): 117-123
[9]李敏, 张倩芳, 栗红瑜, 等. 加工方式对藜麦化学成分及风味的影响[J]. 农产品加工, 2021(17): 43-48
LI M, ZHANG Q F, LI H Y, et al. Effects of processing methods on chemical constituents and flavor of quinoa[J]. Farm Products Processing, 2021(17): 43-48
[10]梁雪梅. 加工方式对绿豆芽多酚抗氧化活性及理化特性的影响[D]. 大庆: 黑龙江八一农垦大学, 2020: 53
LIANG X M. Effects of processing methods on antioxidant activity and physical and chemical properties of mung bean sprout polyphenols[D].Daqing: Heilongjiang Bayi Agricultural University, 2020: 53
[11]SHARMA P, GUJRAL H S. Antioxidant and polyphenol oxidase activity of germinated barley and its milling fractions[J]. Food Chemistry, 2010, 120(3): 673-678
[12]SUBBA RAO, M V S S T, MURALIKRISHNA G. Evaluation of the antioxidant properties of free and bound phenolic acids from native and malted finger millet (ragi, Eleusine coracana Indaf-15)[J]. Journal of Agricultural &FoodChemistry, 2002, 50(4): 889-892
[13]HIRTH M, PREIβ R, MAYER-MIEBACH E, et al. Influence of HTST extrusion cooking process parameters on the stability of anthocyanins, procyanidins and hydroxycinnamic acids as the main bioactive chokeberry polyphenols[J]. LWT - Food Science and Technology, 2015, 62(1): 511-516
[14]GONG K, CHEN L, LI X, et al. Effects of germination combined with extrusion on the nutritional composition, functional properties and polyphenol profile and related in vitro hypoglycemic effect of whole grain corn[J]. Journal of Cereal Science, 2018, 83: 1-8
[15]赵萌萌,张文刚,党斌,等. 超微粉碎对青稞麸皮粉多酚组成及抗氧化活性的影响[J]. 农业工程学报, 2020, 36(15): 291-298
ZHAO M M, ZHANG W G, DANG B, et al. Effects of ultra-micro-crushing on composition of polyphenols and antioxidant activity of barley bran powder [J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(15): 291-298
[16]TSOLMON B, FANG Y, YANG T, et al. Structural identification and UPLC-ESI-QTOF-MS2 analysis of flavonoids in the aquatic plant Landoltia punctata and their in vitro and in vivo antioxidant activities [J]. Food Chemistry, 2021, 343: 1-33
[17]陈金祥. 酚酸抗氧化活性的构效关系及抗氧化机制的研究[D]. 太原: 中北大学, 2020: 6
CHEN J X. Study on antioxidant structure-activity relationship and mechanism of phenolic acids[D]. Taiyuan: North University of China, 2020: 6
[18]IQBAL Y, PONNAMPALAM E N, SULERIA H A R,et al. LC-ESI/QTOF-MS profiling of chicory and lucerne polyphenols and their antioxidant activities[J]. Antioxidants (Basel), 2021, 10(6): 1-16
[19]MOLINER C, LOPEZ V, BARROS L, et al. Rosemary flowers as edible plant foods: phenolic composition and antioxidant properties in caenorhabditis elegans[J]. Antioxidants (Basel), 2020, 9(9): 1-11
[20]SHARMA S, SAXENA D C, RIAR C S. Changes in the GABA and polyphenols contents of foxtail millet on germination and their relationship with in vitro antioxidant activity[J]. Food Chemistry, 2018, 245: 863-870
[21]CHAUHAN E S, SARITA S J C R I N, JOURNAL F S. Effects of processing(germination and popping) on the nutritional and anti-nutritional properties of finger millet(Eleusine coracana) [J]. 2018, 6(2): 566-572
[22]YOUSAF L, HOU D, LIAQAT H, et al. Millet: a review of its nutritional and functional changes during processing[J]. Food Research International, 2021, 142: 1-13
[23]LIU S, WANG W, LU H, et al. New perspectives on physiological, biochemical and bioactive components during germination of edible seeds: a review[J]. Trends in Food Science &Technology, 2022, 123: 187-197
[24]WEN C, SONG D, ZHUANG L, et al. Isolation and identification of polyphenol monomers from celery leaves and their structure-antioxidant activity relationship [J]. Process Biochemistry, 2022, 121: 69-77
[25]BEITANE I, ZEMTURE G K, SABOVICS M. Effect of germination and extrusion on the phenolic content and antioxidant activity of raw buckwheat(Fagopyrum esculentum Moench)[J]. Agronomy Research, 2018: 1331-1340
[26]MA X, LIU Y, LIU J, et al. Changes in starch structures and in vitro digestion characteristics during maize (Zea mays L.) germination[J]. Food Science &Nnutrition, 2020, 8(3): 1-9
[27]KHOSRAVI A, RAZAVI S H. The role of bioconversion processes to enhance bioaccessibility of polyphenols in rice[J]. Food Bioscience, 2020, 35: 1-12
[28]田怀香, 陈霜, 陈小燕, 等. 不同提取方式对萱草花中酚类物质及抗氧化活性的影响[J]. 农业工程学报, 2021, 37(20): 303-312
TIAN H X, CHEN S, CHEN X Y, et al. Effects of different extraction methods on phenolic compounds and antioxidant activity in Hemerocallis flower[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(20): 303-312
[29]李伟, 叶嘉宜, 陈运娇, 等. 桉叶多酚提取物体内外抗氧化活性评价[J]. 食品科学, 2021, 42(5): 160-168
LI W, YE J Y, CHEN Y J, et al. Antioxidant activity of eucalyptus leaf polyphenol extract in vitro and in vivo[J]. Food Science, 2021, 42(5): 160-168
[30]WANG H, JIE L, TONG L, et al. Blueberry extract promotes longevity and stress tolerance via DAF-16 in Caenorhabditis elegans[J]. Food &Function, 2018, 9: 1-10
[31]王红, 张晓寒, 程静, 等. 紫薯提取物对秀丽隐杆线虫抗氧化作用的影响[J]. 食品科学, 2017, 38(23):165-170
WANG H, ZHANG X H, CHENG J, et al. Antioxidant effect of purple sweet potato extract in Caenorhabditis elegans[J]. Food Science, 2017, 38(23): 165-170
[32]王立峰, 鞠兴荣. 3种薏米的多酚提取物清除过氧化氢自由基抗氧化能力评价[J]. 食品科学, 2012, 33(19): 39-44
WANG L F, JU X R. Polyphenol content and hydrogen peroxide radical-scavenging capacity of extracts from three cultivars of adlay[J]. Food Science, 2012, 33(19):39-44
[33]王猛, 马浩天, 关思宇, 等. 螺旋藻多糖对秀丽隐杆线虫氧化应激及寿命的影响[J]. 中国食品学报, 2022, 22(5): 137-146
WANG M, MA H T, GUAN S Y,et al. Effects of spirulina polysaccharides on oxidative stress and life span of Caenorhabditis elegans[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(5): 137-146
[34]MOLINER C, BARROS L, DIAS M I, et al. Viola cornuta and viola x wittrockiana: phenolic compounds, antioxidant and neuroprotective activities on Caenorhabditis elegans [J].Journal of Food and Drug Analysis, 2019, 27(4): 849-859.
(山东省农业科学院作物研究所 苏情、陈利容、孙琳琳、杨延兵、郭玉秋、王兴亚、刘开昌、龚魁杰)